Sublimacja i resublimacja to fascynujące przemiany fazowe materii, które często umykają naszej uwadze, choć są wszechobecne w otaczającym nas świecie. Zrozumienie tych zjawisk jest kluczowe nie tylko dla chemików czy fizyków, ale dla każdego, kto chce głębiej poznać, jak materia zmienia swoje stany i dlaczego dzieje się to w tak zaskakujący sposób.
Sublimacja i resublimacja to bezpośrednie przemiany fazowe materii, kluczowe dla zrozumienia wielu zjawisk.
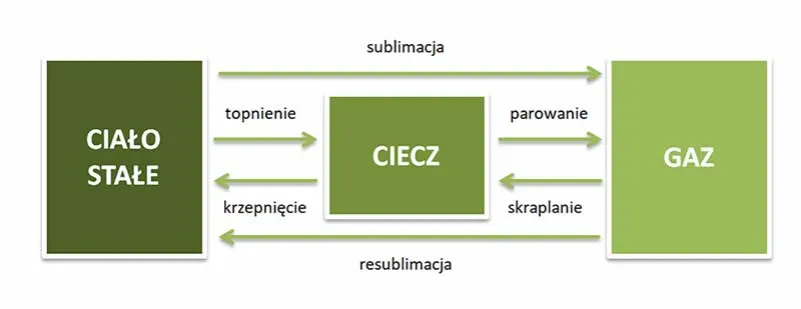
- Sublimacja to proces, w którym substancja przechodzi bezpośrednio ze stanu stałego w gazowy, z pominięciem fazy ciekłej.
- Resublimacja jest procesem odwrotnym, polegającym na bezpośrednim przejściu substancji ze stanu gazowego w stały.
- Obie przemiany zachodzą w specyficznych warunkach ciśnienia i temperatury, często poniżej tzw. punktu potrójnego.
- Przykłady sublimacji obejmują suchy lód, znikające pranie na mrozie oraz naftalinę.
- Resublimację obserwujemy podczas powstawania szronu, tworzenia się śnieżynek czy osadzania sadzy w kominach.
- Zjawiska te mają liczne zastosowania w technologii, takie jak liofilizacja żywności czy druk sublimacyjny.
Zrozumieć sublimację i resublimację: przemiany materii, które zaskakują
Definicja dla każdego: Jak ciało stałe zamienia się w gaz z pominięciem cieczy?
Zacznijmy od sublimacji. W najprostszych słowach, sublimacja to proces, w którym substancja przechodzi bezpośrednio ze stanu stałego w stan gazowy, całkowicie pomijając fazę ciekłą. Zazwyczaj, gdy podgrzewamy lód, najpierw topi się on w wodę, a dopiero potem woda paruje. W przypadku sublimacji ten pośredni etap po prostu nie występuje. Najbardziej znanym przykładem jest suchy lód, czyli stały dwutlenek węgla w temperaturze pokojowej nie topi się on, lecz od razu zamienia w gaz, tworząc charakterystyczną mgłę. Podobnie dzieje się z lodem na mrozie; mokre pranie potrafi wyschnąć nawet przy ujemnych temperaturach, ponieważ woda zamarznięta w tkaninach sublimuje.
Proces odwrotny: Czym jest resublimacja i dlaczego nazywamy ją tworzeniem szronu?
Resublimacja to z kolei proces odwrotny do sublimacji. Polega na bezpośrednim przejściu substancji ze stanu gazowego w stały, również z pominięciem fazy ciekłej. Myślę, że najłatwiej to sobie wyobrazić na przykładzie szronu. Gdy para wodna w powietrzu styka się z bardzo zimną powierzchnią, na przykład szybą samochodu czy gałęzią drzewa, nie skrapla się najpierw w wodę, lecz od razu zamienia w drobne kryształki lodu, tworząc malowniczy szron. To właśnie jest resublimacja w czystej postaci gaz staje się ciałem stałym bez pośrednictwa cieczy.
Kluczowa różnica: Sublimacja a parowanie dlaczego to nie to samo?
Wiele osób myli sublimację z parowaniem, ale to dwie różne przemiany. Kluczowa różnica polega na stanie początkowym substancji. Parowanie to przejście ze stanu ciekłego w gazowy, natomiast sublimacja to przejście ze stanu stałego w gazowy. Warunki, w jakich zachodzą te procesy, również się różnią. Sublimacja często wymaga specyficznych warunków ciśnienia i temperatury, o czym opowiem za chwilę. Parowanie może zachodzić w szerokim zakresie temperatur, o ile tylko ciecz ma dostęp do energii.
| Cecha | Sublimacja | Parowanie |
|---|---|---|
| Stan początkowy | Stały | Ciekły |
| Stan końcowy | Gazowy | Gazowy |
| Faza pośrednia | Brak fazy ciekłej | Brak fazy stałej |
| Warunki | Specyficzne warunki ciśnienia i temperatury (często poniżej punktu potrójnego) | Szeroki zakres temperatur (powyżej punktu potrójnego) |
| Przykład | Suchy lód zamieniający się w gaz | Woda zamieniająca się w parę |
Niezbędne warunki: kiedy i dlaczego zachodzi sublimacja?
Tajemniczy "punkt potrójny": Co mówi nam o zachowaniu substancji?
Aby zrozumieć, kiedy zachodzi sublimacja i resublimacja, musimy poznać pojęcie punktu potrójnego. Jest to unikalna kombinacja ciśnienia i temperatury, w której dana substancja może istnieć jednocześnie we wszystkich trzech stanach skupienia: stałym, ciekłym i gazowym, będąc w równowadze. Dla wody punkt potrójny wynosi 0,01°C (273,16 K) i ciśnienie 611,73 Pa. To ważne, ponieważ to właśnie poniżej tego punktu, czyli przy niższym ciśnieniu i/lub niższej temperaturze, faza ciekła dla danej substancji po prostu nie występuje. W takich warunkach, jeśli dostarczymy energię do ciała stałego, przejdzie ono bezpośrednio w gaz czyli sublimuje. Jeśli natomiast gaz odda energię, zamieni się bezpośrednio w ciało stałe czyli resublimuje.
Dlaczego niektóre substancje sublimują łatwiej niż inne?
Nie wszystkie substancje sublimują z taką samą łatwością. To, czy dana substancja łatwo sublimuje, zależy od kilku czynników, przede wszystkim od jej ciśnienia pary nasyconej oraz od sił międzycząsteczkowych. Substancje o wysokim ciśnieniu pary nasyconej, czyli takie, których cząsteczki łatwo odrywają się od powierzchni ciała stałego i przechodzą w fazę gazową, będą sublimować łatwiej. Ponadto, słabe siły międzycząsteczkowe sprzyjają sublimacji. Do substancji, które łatwo sublimują nawet w normalnych warunkach ciśnienia i temperatury, należą:
- Jod: Po podgrzaniu tworzy piękne fioletowe pary, nie topiąc się.
- Kamfora: Używana w medycynie i do produkcji celuloidu, powoli sublimuje w temperaturze pokojowej.
- Naftalina: Składnik kulek na mole, znany z charakterystycznego zapachu i stopniowego zanikania.
- Kwas benzoesowy: Często oczyszczany metodą sublimacji w laboratorium.
Diagram fazowy wody: Graficzne wyjaśnienie, kiedy lód sublimuje
Diagram fazowy to niezwykle przydatne narzędzie, które wizualnie przedstawia, w jakich warunkach ciśnienia i temperatury substancja występuje w danym stanie skupienia. Patrząc na diagram fazowy wody, możemy wyraźnie zobaczyć, że obszar sublimacji lodu znajduje się poniżej punktu potrójnego. Oznacza to, że przy ciśnieniach niższych niż ciśnienie punktu potrójnego (dla wody 611,73 Pa), lód będzie przechodził bezpośrednio w parę wodną, niezależnie od temperatury (o ile jest ona poniżej 0,01°C). To właśnie dlatego lód w zamrażarce, choć nie topnieje, z czasem zmniejsza swoją objętość sublimuje.

Sublimacja wokół nas: codzienne przykłady fascynującego zjawiska
Sublimacja to zjawisko, które choć często niezauważane, odgrywa rolę w wielu codziennych sytuacjach. Przyjrzyjmy się kilku z nich.
Znikające pranie na mrozie: Najczęstszy przykład sublimacji w polskim klimacie
Kto z nas nie widział mokrego prania, które wyschło na sznurku podczas mroźnej zimy? To doskonały przykład sublimacji. Woda zamarznięta w tkaninach, choć jest w stanie stałym (lód), w odpowiednich warunkach niskiej temperaturze (poniżej 0°C), niskiej wilgotności powietrza i często przy wietrze sublimuje. Cząsteczki lodu bezpośrednio przechodzą w parę wodną, omijając fazę ciekłą. Dlatego pranie staje się suche, choć temperatura nigdy nie przekroczyła zera.
Suchy lód w roli głównej: Efektowna mgła to nic innego jak sublimujący dwutlenek węgla
Suchy lód, czyli stały dwutlenek węgla (CO2), jest chyba najbardziej widowiskowym przykładem sublimacji. W temperaturze pokojowej i pod ciśnieniem atmosferycznym, suchy lód nie topi się, lecz sublimuje w temperaturze około -78,5°C. Powstająca "mgła" to w rzeczywistości para wodna z otoczenia, która skrapla się i resublimuje w kontakcie z bardzo zimnym gazowym dwutlenkiem węgla. Suchy lód jest często wykorzystywany do tworzenia efektów specjalnych na scenie, do chłodzenia produktów spożywczych podczas transportu, a także w laboratoriach.
Zapachowe kostki i kulki na mole: Jak naftalina powoli znika z szafy?
Pamiętacie kulki na mole lub zapachowe kostki do szaf? Ich działanie opiera się właśnie na sublimacji. Substancje takie jak naftalina czy kamfora, z których są wykonane, w temperaturze pokojowej powoli sublimują. Oznacza to, że ich cząsteczki stopniowo odrywają się od powierzchni ciała stałego i przechodzą w stan gazowy, uwalniając charakterystyczny zapach. Dzięki temu mole są odstraszane, a ubrania zyskują specyficzny aromat, a sama kostka po pewnym czasie po prostu znika.
Resublimacja w naturze i przemyśle: od szronu po czyste substancje
Podobnie jak sublimacja, resublimacja również ma swoje miejsce w naturze i technologii, często w mniej oczywisty sposób.
Malowniczy szron na szybach: Idealny przykład resublimacji pary wodnej
Szron to jeden z najpiękniejszych i najbardziej powszechnych przykładów resublimacji. Gdy temperatura powietrza spada poniżej zera, a w powietrzu znajduje się para wodna, para ta może bezpośrednio zamienić się w kryształki lodu na zimnych powierzchniach. Dzieje się tak, ponieważ cząsteczki pary wodnej, tracąc energię, nie przechodzą przez fazę ciekłą, ale od razu układają się w strukturę krystaliczną lodu. Efektem są te malownicze, lodowe wzory, które często podziwiamy na szybach czy roślinach.
Śnieżynki prosto z chmur: Jak kryształki lodu tworzą się w atmosferze?
Tworzenie się śnieżynek w chmurach to również przykład resublimacji. W górnych warstwach atmosfery, gdzie panują bardzo niskie temperatury, para wodna osadza się bezpośrednio na tzw. jądrach kondensacji (np. drobinkach pyłu) i zamienia się w kryształki lodu. Te kryształki rosną, łączą się ze sobą i w końcu, gdy stają się wystarczająco ciężkie, opadają na ziemię jako śnieg. Każda śnieżynka to unikalny, sześcioramienny kryształek lodu, który powstał w wyniku tego procesu.
Sadza w kominie: Mniej romantyczny, ale ważny przykład resublimacji
Mniej poetyckim, ale równie ważnym przykładem resublimacji jest osadzanie się sadzy w kominach. Podczas spalania paliw, w dymie znajdują się lotne związki węgla. Gdy te gorące gazy stygną w kontakcie z chłodniejszymi ściankami komina, węgiel w formie gazowej resublimuje, osadzając się jako stała sadza. Jest to niepożądane zjawisko, ponieważ sadza zmniejsza drożność komina i zwiększa ryzyko pożaru, ale stanowi klarowny przykład bezpośredniego przejścia gazu w ciało stałe.
Przeczytaj również: Co to jest zjawisko fizyczne? Prosta definicja i przykłady z życia
Innowacyjne zastosowania: jak wykorzystujemy sublimację i resublimację w technologii?
Zjawiska sublimacji i resublimacji, choć pozornie proste, znalazły szerokie zastosowanie w nowoczesnych technologiach, od przemysłu spożywczego po zaawansowaną chemię.
Liofilizacja, czyli "suszenie mrozem": Jak powstaje kawa rozpuszczalna i żywność dla astronautów?
Liofilizacja, znana również jako suszenie sublimacyjne, to jedna z najważniejszych technik konserwacji żywności i preparatów farmaceutycznych. Proces ten polega na zamrożeniu produktu, a następnie umieszczeniu go w komorze próżniowej, gdzie lód sublimuje, czyli przechodzi bezpośrednio w parę wodną. Dzięki temu woda jest usuwana z produktu bez podgrzewania, co pozwala zachować jego strukturę, smak, aromat i wartości odżywcze. Jest to metoda droższa niż tradycyjne suszenie, ale jej zalety są nieocenione. Liofilizacja jest wykorzystywana do produkcji:
- Kawy rozpuszczalnej: Zachowuje bogaty aromat i smak świeżo parzonej kawy.
- Owoców liofilizowanych: Idealne jako przekąski, dodatki do musli czy składniki deserów.
- Dania instant dla turystów i wspinaczy: Lekkie, łatwe do przygotowania i pełnowartościowe.
- Żywności dla astronautów: Niska masa i długa trwałość są kluczowe w kosmosie.
- Preparatów farmaceutycznych i biologicznych: Konserwacja szczepionek, enzymów czy bakterii.
Twój ulubiony kubek z nadrukiem: Magia druku sublimacyjnego
Czy zastanawialiście się kiedyś, jak powstają te trwałe i kolorowe nadruki na kubkach, koszulkach czy podkładkach pod mysz? To zasługa druku sublimacyjnego. W tej technice specjalny barwnik jest podgrzewany do stanu gazowego, a następnie pod wpływem ciśnienia przenika w strukturę materiału (najczęściej poliestrowego lub pokrytego poliestrem). Tam, w niższej temperaturze, barwnik resublimuje, czyli przechodzi z powrotem w stan stały, trwale wiążąc się z włóknami materiału. Dzięki temu nadruk jest nie tylko bardzo trwały i odporny na ścieranie czy pranie, ale także niezwykle wyrazisty i nasycony kolorami.
Czystość w laboratorium: Jak chemicy oczyszczają substancje dzięki sublimacji?
W chemii laboratoryjnej i przemyśle sublimacja i resublimacja są wykorzystywane jako skuteczna metoda oczyszczania substancji. Jeśli mamy do czynienia z substancją stałą, która łatwo sublimuje (np. jod, siarka, kwas benzoesowy, salmiak), możemy ją podgrzać w specjalnym aparacie. Substancja przechodzi w stan gazowy, a zanieczyszczenia pozostają w fazie stałej. Następnie pary czystej substancji są kierowane na chłodną powierzchnię, gdzie resublimują, tworząc czyste kryształy. Jest to szczególnie przydatne, gdy chcemy uzyskać substancje o bardzo wysokim stopniu czystości. Technika ta znajduje również zastosowanie w przemyśle półprzewodników do nanoszenia cienkich, jednorodnych warstw materiałów na podłoża.

