Eksperyment z hodowlą kryształów soli w słoiku to fascynująca podróż w świat chemii, którą z łatwością można odbyć w domowym zaciszu. Jest to idealna aktywność dla dzieci i rodziców, pozwalająca na wspólne odkrywanie naukowych zjawisk w przystępny i bezpieczny sposób. W tym artykule znajdziesz szczegółową instrukcję krok po kroku, wyjaśnienie, co dokładnie dzieje się w słoiku, a także praktyczne porady, jak rozwiązać najczęstsze problemy i jak urozmaicić eksperyment.
Hodowla kryształów soli w słoiku prosty eksperyment dla małych odkrywców
- Eksperyment polega na tworzeniu kryształów soli z roztworu nasyconego, demonstrując proces krystalizacji.
- Do przeprowadzenia potrzebujesz soli kuchennej (najlepiej niejodowanej), gorącej wody, słoika, nitki i ołówka.
- Pierwsze kryształki pojawiają się po kilku godzinach, a na większe struktury czeka się od kilku dni do 2-3 tygodni.
- To bezpieczny i popularny sposób na naukę chemii i fizyki w domu lub w szkole podstawowej.
- Kluczem do sukcesu jest cierpliwość, odpowiednie przygotowanie roztworu i stabilne środowisko.
Zanim zaczniesz: Dlaczego hodowanie kryształów soli to idealny eksperyment na start
Czego nauczy ten eksperyment?
Jako osoba, która widziała wiele dzieciaków zafascynowanych nauką, mogę śmiało powiedzieć, że ten eksperyment to strzał w dziesiątkę. Hodowanie kryształów soli to coś więcej niż tylko zabawa to prawdziwa lekcja nauki, która rozwija wiele kluczowych umiejętności. Dzieci uczą się o:
- Krystalizacji: Jak substancje tworzą uporządkowane struktury.
- Roztworach i stężeniu: Czym jest roztwór nasycony i dlaczego jest tak ważny.
- Parowaniu: Jak woda zmienia stan skupienia i co to oznacza dla roztworu.
- Cierpliwości: Duże i piękne kryształy wymagają czasu.
- Obserwacji: Regularne sprawdzanie słoika uczy dostrzegania drobnych zmian.
- Myśleniu przyczynowo-skutkowym: Zrozumienie, dlaczego pewne działania prowadzą do konkretnych rezultatów.
To doskonałe wprowadzenie do pojęć z przyrody i chemii, często poruszanych w szkole podstawowej. Pozwala na naukę poprzez doświadczenie, co jest najskuteczniejszą formą przyswajania wiedzy.
Bezpieczeństwo przede wszystkim
Chociaż eksperyment z solą jest jednym z najbezpieczniejszych, zawsze pamiętajmy o kilku podstawowych zasadach. Przede wszystkim, wszystkie etapy z gorącą wodą powinny odbywać się pod ścisłym nadzorem osoby dorosłej. Ostrożność z wrzątkiem to podstawa. Poza tym, warto wybrać stabilne i spokojne miejsce na słoik, z dala od małych rączek, zwierząt domowych i przeciągów, aby uniknąć przypadkowego przewrócenia czy zakłócenia procesu.
Sekret udanego roztworu: Sól i woda
Jaka sól będzie najlepsza?
Do naszego eksperymentu najlepiej sprawdzi się sól kuchenna niejodowana. Dlaczego? Jod i inne dodatki, które często znajdują się w soli jodowanej, mogą nieznacznie zaburzać proces krystalizacji, wpływając na kształt i wielkość kryształów. Zwykła, gruboziarnista sól kamienna bez dodatków będzie idealna, ponieważ jej większe cząstki mogą stanowić lepsze "zarodki" dla nowych kryształów.
Dlaczego gorąca woda to podstawa?
Kluczem do sukcesu jest stworzenie roztworu nasyconego, a gorąca woda jest tu naszym największym sprzymierzeńcem. W wyższej temperaturze cząsteczki wody są bardziej ruchliwe i mają większą zdolność do rozpuszczania substancji stałych, takich jak sól. Dzięki temu możemy rozpuścić znacznie więcej soli w gorącej wodzie niż w zimnej, co jest niezbędne do późniejszego tworzenia się dużych kryształów.

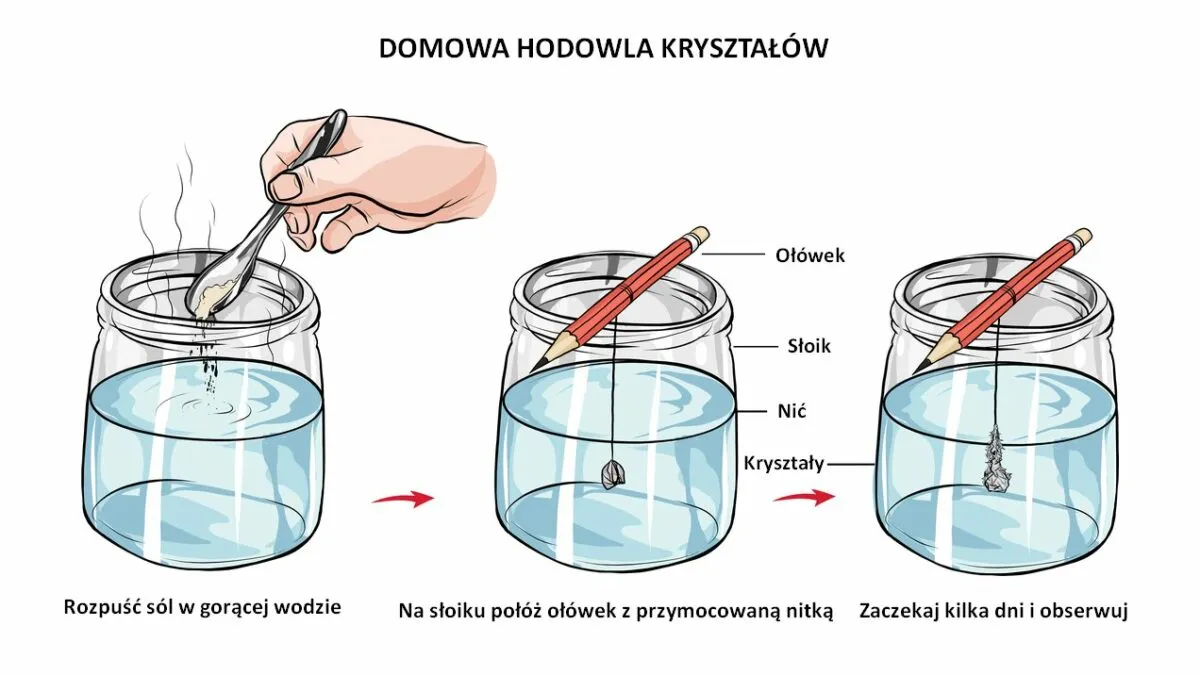
Magia w słoiku: Instrukcja krok po kroku, która zawsze się udaje
Niezbędne materiały
Zanim zaczniemy, upewnijmy się, że mamy wszystko pod ręką. Przygotuj:
- Sól kuchenna (najlepiej niejodowana, duża paczka).
- Gorąca woda (najlepiej destylowana, ale kranówka też się nada).
- Słoik (przezroczysty, czysty, o dowolnej wielkości).
- Nitka (bawełniana lub wełniana, np. sznurek do szycia lub kordonek).
- Ołówek lub patyczek (do zawieszenia nitki).
- Łyżka do mieszania.
- Garnek do zagotowania wody.
Przygotowanie roztworu nasyconego
To najważniejszy etap, więc poświęćmy mu szczególną uwagę. Pamiętaj, że tutaj nadzór dorosłego jest absolutnie konieczny!
- Zagotuj wodę: Wlej wodę do garnka i zagotuj ją. Im gorętsza woda, tym więcej soli rozpuści.
- Dodawaj sól stopniowo: Ostrożnie wsypuj sól do gorącej wody, cały czas mieszając. Zauważysz, że sól będzie się rozpuszczać.
- Mieszaj, aż do nasycenia: Kontynuuj dodawanie soli i mieszanie, aż do momentu, gdy sól przestanie się rozpuszczać i zacznie osiadać na dnie garnka. To znak, że roztwór jest nasycony woda nie jest już w stanie przyjąć więcej soli.
- Przelej roztwór: Ostrożnie przelej gorący, nasycony roztwór do czystego słoika. Staraj się nie wlewać nierozpuszczonej soli z dna garnka potrzebujemy klarownego roztworu.
Przygotowanie "rusztowania" dla kryształów
Nitka będzie naszym "rusztowaniem", na którym zaczną osadzać się kryształy.
- Przygotuj nitkę: Odetnij kawałek nitki, który będzie na tyle długi, aby swobodnie zwisać w słoiku, nie dotykając dna ani ścianek.
- Przywiąż do ołówka: Jeden koniec nitki przywiąż do środka ołówka lub patyczka.
- Umieść w słoiku: Połóż ołówek na brzegu słoika tak, aby nitka zwisała swobodnie w roztworze. Upewnij się, że nitka jest zanurzona, ale nie dotyka dna ani ścianek słoika. To bardzo ważne, aby kryształy mogły swobodnie rosnąć.
Cierpliwość kluczem do sukcesu
Teraz pozostaje nam czekać. Umieść słoik w spokojnym, stabilnym miejscu, gdzie nie będzie narażony na wstrząsy, przeciągi ani bezpośrednie działanie promieni słonecznych. Idealna będzie półka w pokoju, z dala od okna i kaloryfera. Pierwsze, malutkie kryształki mogą pojawić się już po kilku godzinach, ale na większe i bardziej imponujące struktury trzeba będzie poczekać od kilku dni do nawet 2-3 tygodni. Pamiętaj, cierpliwość to cnota każdego naukowca! Im wolniej woda paruje i stygnie, tym większe i piękniejsze kryształy powstaną.
Co dokładnie dzieje się w środku? Wyjaśniamy naukę prostymi słowami
Sól w gorącej wodzie jak to działa?
Kiedy wsypujemy sól do gorącej wody, dzieje się coś fascynującego na poziomie molekularnym. Sól kuchenna (chlorek sodu, NaCl) składa się z maleńkich cząsteczek sodu i chloru, które są ze sobą mocno związane. Cząsteczki wody, będące bardzo ruchliwe w wysokiej temperaturze, otaczają te cząsteczki soli i dosłownie je "rozdzielają", wciągając je do roztworu. Można to sobie wyobrazić, jakby woda była gigantyczną armią, która rozbija fortecę soli na pojedyncze cegiełki i rozprowadza je po całym swoim terytorium.
Krystalizacja magia czy nauka?
Gdy roztwór soli zaczyna stygnąć i woda powoli paruje, sytuacja się zmienia. Woda traci swoją zdolność do utrzymywania tak dużej ilości soli w roztworze. Cząsteczki soli, które wcześniej były swobodnie rozproszone, zaczynają się ponownie łączyć. Robią to w bardzo uporządkowany sposób, tworząc regularne struktury kryształy. To trochę tak, jakby cegiełki, które wcześniej zostały rozproszone, teraz zaczęły się układać w precyzyjny wzór, budując nową, piękną budowlę. Nitka, którą zawiesiliśmy, działa jak idealne miejsce, gdzie te pierwsze "cegiełki" mogą się zaczepić i rozpocząć budowę kryształu.
Dlaczego kryształy soli są sześcienne?
Kształt kryształów soli nie jest przypadkowy. Chlorek sodu (NaCl) ma bardzo specyficzną budowę atomową jony sodu i chloru układają się w przestrzenną sieć krystaliczną, która jest regularnym sześcianem. Niezależnie od tego, czy kryształ jest malutki, czy duży, jego podstawowa struktura zawsze będzie dążyć do tego sześciennego kształtu. To jeden z najbardziej klasycznych przykładów, jak niewidzialny świat atomów wpływa na makroskopowe właściwości substancji, które możemy obserwować gołym okiem.
Mój eksperyment nie wyszedł! Najczęstsze problemy i ich rozwiązania
Kryształy na dnie słoika zamiast na nitce
Jeśli zauważysz, że większość kryształów osadza się na dnie słoika, a nie na zawieszonej nitce, prawdopodobnie roztwór stygł zbyt szybko lub był zbyt mocno nasycony na początku. Szybkie chłodzenie powoduje, że sól wytrąca się z roztworu wszędzie tam, gdzie znajdzie najmniejszą nierówność w tym na dnie słoika. Aby temu zapobiec, spróbuj delikatniej schładzać roztwór na przykład, zamiast stawiać słoik od razu w chłodnym miejscu, pozwól mu ostygnąć w temperaturze pokojowej, a nawet owiń go ręcznikiem, aby spowolnić proces utraty ciepła.
Powstało wiele małych kryształków, a nie jeden duży
Ten problem również często wynika z zbyt szybkiego stygnięcia roztworu lub zbyt wielu punktów krystalizacji. Kiedy roztwór stygnie za szybko, wiele małych cząsteczek soli jednocześnie zaczyna tworzyć zarodki kryształów, zamiast pozwolić kilku większym rosnąć. Aby uzyskać większe kryształy, postaraj się o jak najwolniejsze i najbardziej stabilne chłodzenie. Unikaj poruszania słoikiem i upewnij się, że w roztworze nie ma zbyt wielu zanieczyszczeń, które mogłyby stać się dodatkowymi punktami krystalizacji. Czasami warto też spróbować zawiesić na nitce mały "zarodek" kryształu (np. jeden mały kryształek soli), który będzie stanowił preferowane miejsce wzrostu.
Nic się nie dzieje, roztwór pozostaje klarowny
Jeśli po kilku dniach nic się nie dzieje, a roztwór pozostaje idealnie klarowny, najprawdopodobniej roztwór nie był wystarczająco nasycony. Oznacza to, że woda nadal jest w stanie utrzymać całą rozpuszczoną sól. Co możesz zrobić? Po pierwsze, sprawdź, czy słoik nie był poruszany wstrząsy mogą zakłócać proces. Następnie, możesz spróbować ponownie podgrzać roztwór i dosycić go solą, dodając jej jeszcze więcej, aż do momentu, gdy zacznie osiadać na dnie. Innym rozwiązaniem jest dodanie do roztworu małego "zarodka" kryształu na przykład małego kryształka soli, który posłuży jako punkt startowy dla wzrostu większych kryształów.
Podnieś poziom trudności: Kreatywne warianty eksperymentu z solą
Kolorowe kryształy
Jeśli podstawowy eksperyment już opanowaliście, czas na odrobinę koloru! Aby uzyskać barwne kryształy, wystarczy dodać kilka kropli barwnika spożywczego do gorącego, nasyconego roztworu soli, zanim włożymy nitkę. Możecie przygotować kilka słoików, każdy z innym kolorem, i obserwować, jak powstają tęczowe kryształy. Pamiętajcie, że barwnik może nieznacznie wpłynąć na proces krystalizacji, ale efekt wizualny z pewnością wynagrodzi ewentualne drobne różnice.
Kryształowa geoda w skorupce jajka
Ten wariant to prawdziwa gratka dla miłośników natury i geologii! Zamiast słoika, jako formy do hodowli kryształów użyjemy połówki skorupki jajka. Najpierw delikatnie umyj i wysusz połówkę skorupki. Możesz ją pomalować od zewnątrz, aby nadać jej estetyczny wygląd. Następnie, wlej do niej nasycony roztwór soli. Kryształy będą osadzać się na wewnętrznej powierzchni skorupki, tworząc efektowną, błyszczącą geodę. To świetny sposób na pokazanie, jak kryształy mogą rosnąć na nieregularnych powierzchniach.
Przeczytaj również: Fascynujące eksperymenty z lodem: Nauka przez zabawę dla dzieci
Wpływ temperatury na krystalizację
Dla prawdziwych małych naukowców proponuję eksperyment porównawczy. Przygotujcie trzy identyczne słoiki z nasyconym roztworem soli i nitkami. Następnie umieśćcie je w różnych warunkach temperaturowych: jeden w ciepłym miejscu (np. blisko kaloryfera, ale nie na nim), drugi w temperaturze pokojowej, a trzeci w chłodnym miejscu (np. w piwnicy lub na parapecie zimnego okna). Obserwujcie i notujcie, jak temperatura wpływa na szybkość powstawania kryształów oraz na ich wielkość i kształt. To doskonała lekcja o wpływie czynników zewnętrznych na procesy chemiczne!

